Die neue Medizinprodukte-Verordnung (MDR) der Europäischen Union, die eine Verbesserung der klinischen Sicherheit zum Ziel hat, trat am 26. Mai vollständig in Kraft. Anders als bei Richtlinien müssen Verordnungen nicht in nationale Gesetze umgewandelt werden.
Die Medizinprodukte-Verordnung hat Einfluss auf alle Medizinprodukte, die in Europa verkauft werden, einschließlich der Produkte von Formlabs. Unser Blogbeitrag deckt die häufig gestellten Fragen zur neuen Medizinprodukte-Verordnung ab und wie diese Formlabs und unsere Kunden beeinflusst.
Was ist ein Medizinprodukt?
Ein Medizinprodukt ist als „Instrument, Apparat, dentale Anwendung, Software, Implantat, Reagens, Material oder anderer Artikel“ definiert, der zur Diagnose, Prävention oder Behandlung von Erkrankungen oder Verletzungen verwendet wird.
Welche Produkte von Formlabs sind Medizinprodukte?
| Medizinprodukt | Klasse | Hersteller |
|---|---|---|
| Surgical Guide Resin | Klasse I | Formlabs |
| Custom Tray Resin | Klasse I | Formlabs |
| IBT Resin | Klasse I | Formlabs |
| Dental LT Clear Resin (V2)* | Klasse IIa | Formlabs |
| Dental SG Resin | Klasse I | Drittanbieter |
| Dental LT Clear Resin V1 | Klasse IIa | Drittanbieter |
| Temporary CB Resin | Klasse IIa | Drittanbieter |
| Permanent Crown Resin | Klasse IIa | Drittanbieter |
| Denture Base Resin | Klasse IIa | Drittanbieter |
| Denture Teeth Resin | Klasse IIa | Drittanbieter |
*noch nicht in Europa verfügbar
Wie kann ich sicherstellen, dass die Medizinprodukte von Formlabs, die ich verwende, mit der MDR vom 26. Mai 2021 konform sind?
Produkte der Klasse I – Änderungen treffen nur auf Geräte zu, die nach dem 26. Mai 2021 produziert wurden.
Gemäß der EU-MDR, Artikel 120, Paragraf 4, können Produkte, die rechtmäßig unter Einhaltung der Richtlinie 93/42/EWG (MDD) vor dem 26. Mai 2021 auf den Markt gebracht wurden, bis zum 27. Mai 2025 weiterhin auf dem Markt verfügbar gemacht werden oder in Betrieb genommen werden.
Deshalb zertifiziert Formlabs, dass seine Medizinprodukte der Klasse I, die vor dem 25. Mai 2021 hergestellt wurden und ein maximales Verfallsdatum von nicht später als am 25. Mai 2023 haben, im Einklang mit der EU-MDR verkauft und verwendet werden dürfen.
*Die offizielle Stellungnahme downloaden
Produkte der Klasse IIa – keine Änderungen bis 2024* (für genauere Daten bitte die offizielle Stellungnahme überprüfen)
Gemäß der EU-MDR, Artikel 120, Paragraf 4, können Produkte, die rechtmäßig unter Einhaltung der Richtlinie 93/42/EWG (MDD) mit einem gültigen Zertifikat (gültig bis Ende des auf dem Zertifikat angegebenen Zeitraums) auf den Markt gebracht wurden, bis zum 27. Mai 2025 weiterhin auf dem Markt verfügbar gemacht oder in Betrieb genommen werden.
Deshalb zertifiziert Formlabs, dass seine Medizinprodukte der Klasse IIa im Einklang mit der EU-MDR verkauft und verwendet werden dürfen.
*Die offizielle Stellungnahme downloaden
Welche Änderungen sind bei Medizinprodukten, die von Formlabs nach dem 26. Mai 2021 hergestellt wurden, auf der Kennzeichnung ersichtlich?
Zur Kennzeichnung gehören die Gebrauchsanweisung, das rückseitige Etikett und jedes andere Etikett, das auf der Kartusche oder dem Karton angebracht ist. Die MDR-Kennzeichnung ist anders als die MDD-Kennzeichnung, da sie Folgendes enthalten muss:
-
Ein MD-Symbol (gibt an, dass das Produkt ein Medizinprodukt ist)
-
Name des Importeurs
-
UDI (einmalige Produktkennung)
-
Gebrauchsanweisungen mit klinischen Nutzen, Restrisiken und anderen Anforderungen laut Anhang I
Produkte von Formlabs werden MDR-konforme Kennzeichnung aufweisen (sofern anwendbar). Bitte beachten Sie: Nur weil die Kennzeichnung all das Obengenannte einschließt, heißt das nicht, dass das betreffende Medizinprodukt alle MDR-Anforderungen erfüllt.
Welche Zertifizierungen werden benötigt?
Produkte der Klasse I erfordern keine Zertifizierung, nur eine Konformitätserklärung, die als Selbstzertifizierung des Herstellers dient. Diese Produkte müssen entsprechend der Verordnung hergestellt und gekennzeichnet werden.
Produkte der Klasse IIa erfordern eine EG-Zertifizierung, die von einer benannten Stelle ausgestellt wird, und ebenso eine Konformitätserklärung.
Was bedeuten diese Änderungen für Formlabs?
Diese Veränderungen haben für die Produkte von Formlabs verschiedene Bedeutungen.
Formlabs-Produkte der Klasse I
-
Produkte der Klasse I werden vom Status als MDD-Produkt zum MDR-Produkt wechseln, sobald der Lagerbestand aufgebraucht ist.
-
Formlabs wird eine MDR-Konformitätserklärung haben.
-
Produkte werden MDR-konforme Kennzeichnungen und Gebrauchsanweisungen haben.
Formlabs-Produkte der Klasse IIa
-
Wenn das Dental LT Clear Resin (V2) in Europa verfügbar wird, wird es eine MDR-EG-Zertifizierung haben, und das Qualitätssystem wird MDR-zertifiziert sein.
Drittanbieter-Produkte der Klasse IIa
-
Produkte der Klasse IIa behalten ihr MDD-Zertifikat, und es werden keine Änderungen vorgenommen, bis das Zertifikat ausläuft (abhängig vom Zertifikat, nicht später als 26. Mai 2024).
Ab wann erwarten wir eine MDR-Konformitätserklärung von Formlabs?
Alle von Formlabs vertriebenen Medizinprodukte der Klasse I, die nach dem 26. Mai 2021 hergestellt wurden, benötigen eine neue Konformitätserklärung. Formlabs-Produkte der Klasse I, deren Chargen nach dem 25. Mai 2021 hergestellt wurden, werden eine MDR-Konformitätserklärung haben.
Gilt die MDR-Konformitätserklärung auf Kunstharze und Drucker?
Die MDR-Konformitätserklärung gilt für alle von Formlabs verkauften Kunstharze der Klasse I. Die MDR gilt jedoch nicht für Formlabs-Drucker. Drucker haben eine Konformitätserklärung aufgrund einer anderen Rechtslage.
Was sind die Anforderungen für zahnmedizinische Kunden von Formlabs?
Gemäß der MDR sind Dentallabore und Zahnarztpraxen ab jetzt Hersteller. Jegliche Produkte, die ein Medizinprodukt darstellen, müssen unter Nutzung eines etablierten Qualitätssystems hergestellt werden.
Hersteller müssen:
-
alle anwendbaren Positionen der Grundlegenden Sicherheits- und Leistungsanforderungen erfüllen
-
alle nach Markteinführungen geltenden Anforderungen erfüllen
-
sich als Gerätehersteller (territoriumsspezifisch) registrieren
-
eine Stellungnahme gemäß Anhang XIII (ähnlich einer Konformitätserklärung) schreiben
-
eine für regulatorische Compliance verantwortliche Person benennen
Wie kann Formlabs Kunden helfen, ihren MDR-Verpflichtungen nachzukommen?
Wir können Kunden helfen, die GSLA (Grundlegende Sicherheits- und Leistungsanforderungen) (MDR Anhang I) zu erfüllen, indem wir auf Anfrage Folgendes bieten:
-
Analysezertifikat ⇒ Belegt Chargenkontrolle und -qualität
-
Compliance-Zertifikat ⇒ Belegt Konformität mit Anhang I
Andere Dokumente zur Unterstützung der Compliance:
-
Konformitätserklärung von Medizinprodukten – downloaden Sie die Dokumente für jede Indikation (falls zutreffend) im Abschnitt „Downloads“
-
TDB – downloaden Sie die Dokumente für jede Indikation im Abschnitt „Downloads“
-
SDB – downloaden Sie die Dokumente am Ende der Seite
-
MDR-Compliance-Nachweis für Dentalvorrichtungen der Klasse I (hergestellt vor dem 26. Mai)
-
MDR-Compliance-Nachweis für Dentalvorrichtungen der Klasse IIa
Das webbasierte Dashboard von Formlabs hilft mittels Erfassung von Geräten und Materialien bei den Dokumentationsanforderungen nach Artikel 5.
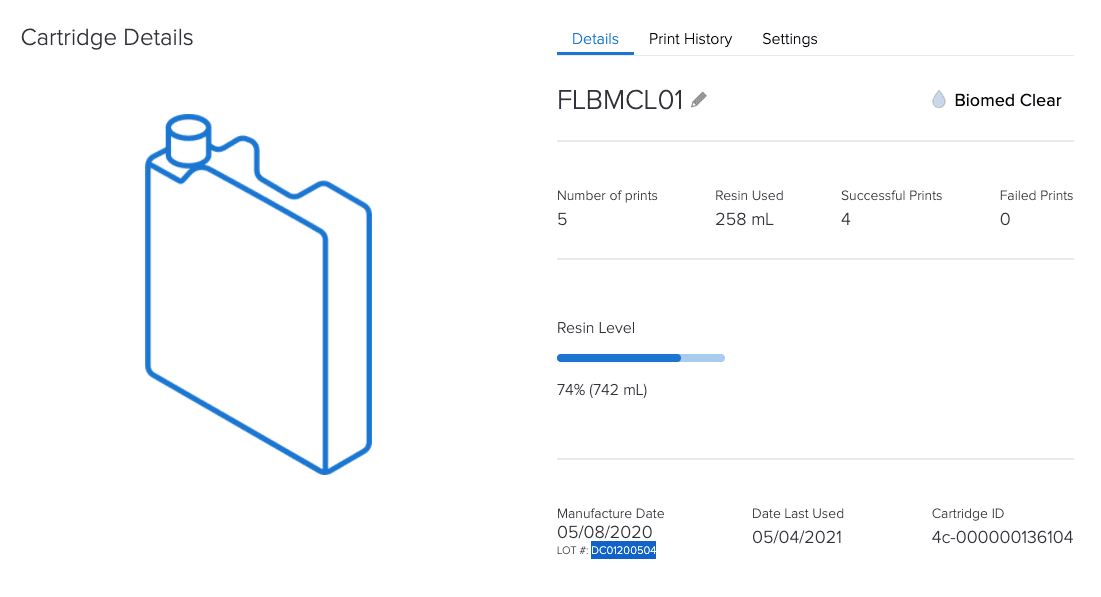
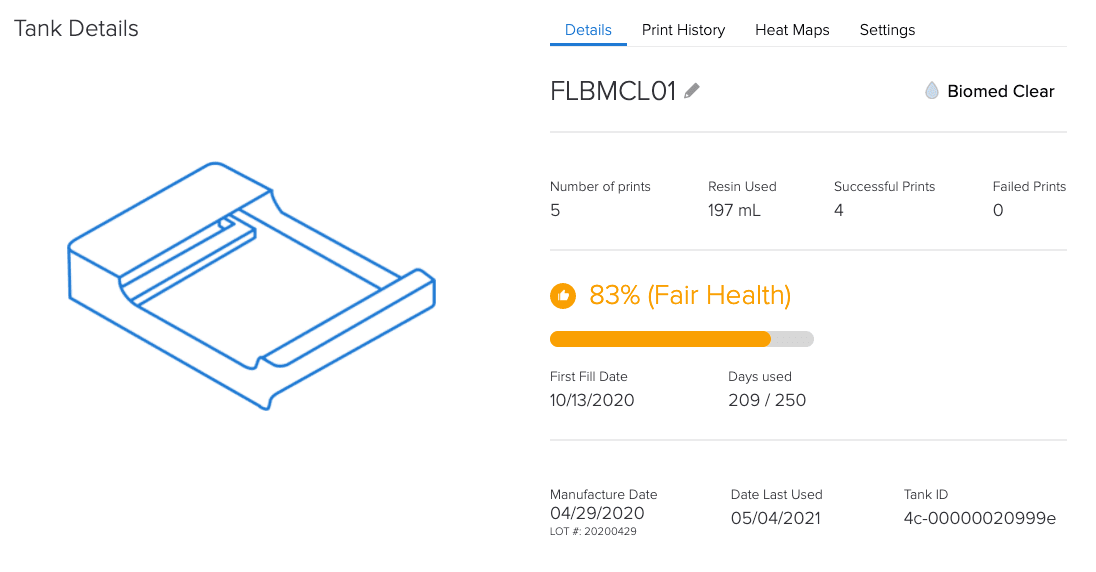
Warum ist ein kontrolliertes Ecosystem von Formlabs hinsichtlich der MDR ein Vorteil?
Da alle zahnmedizinischen Kunden (Labore und Zahnarztpraxen) sowie Institutionen des Gesundheitswesens die MDR-Anforderungen einhalten müssen, kann der Besitz eines kontrollierten Systems Vertrauen und Compliance schaffen.
-
Ein kontrolliertes System ermöglicht für Drucker und Material eine vollständige Absicherung der Compliance zu Anhang I.
-
Eine klinische Bewertung, die das Material und den Drucker unterstützt.
-
Compliance in Form von Dokumentation einer jeden Charge sowie digitaler Dokumentation.
Die Drucker und Materialien von Formlabs sowie die zugehörigen Produkte erfüllen eine Reihe von Sicherheits- und Qualitätsnormen unterschiedlicher Regulierungsorgane. Weitere Informationen finden Sie hier.
Erfahren Sie mehr über MDR
Was ist rund um die neue Medizinprodukte-Verordnung (MDR) der Europäischen Union zu beachten und wie genau betrifft sie Formlabs-Kunden? Sehen Sie sich unser Webinar an, in dem Sam Murray, Director of Regulatory Affairs & Quality Assurance bei Formlabs, alle Einzelheiten hierzu beleuchtet.