Dal 26 maggio è diventato pienamente applicabile il nuovo regolamento dell’Unione Europea sui dispositivi medici (MDR) per il miglioramento della sicurezza in ambito clinico. A differenza delle direttive, i regolamenti non hanno bisogno di essere recepiti nel diritto nazionale.
Il regolamento sui dispositivi medici riguarda tutti i dispositivi medici venduti in Europa, compresi i prodotti Formlabs. Questo articolo risponde alle domande frequenti sul nuovo regolamento sui dispositivi medici e su cosa ha significato per Formlabs e i suoi clienti.
Che cos’è un dispositivo medico?
Per dispositivo medico si intende “qualsiasi strumento, macchinario, apparecchio, software, impianto, reagente, materiale o altro articolo” destinato ad essere utilizzato per la diagnosi, la prevenzione o il trattamento di malattie e lesioni.
Quali prodotti Formlabs sono dispositivi medici?
| Dispositivi medici | Classe | Produttore |
|---|---|---|
| Surgical Guide Resin | Classe I | Formlabs |
| Custom Tray Resin | Classe I | Formlabs |
| IBT Resin | Classe I | Formlabs |
| Dental LT Clear Resin (V2)* | Classe IIa | Formlabs |
| Dental SG Resin | Classe I | Terze parti |
| Dental LT Clear Resin V1 | Classe IIa | Terze parti |
| Temporary CB Resin | Classe IIa | Terze parti |
| Permanent Crown Resin | Classe IIa | Terze parti |
| Denture Base Resin | Classe IIa | Terze parti |
| Denture Teeth Resin | Classe IIa | Terze parti |
*non ancora disponibile in Europa
Come faccio ad avere la certezza che i dispositivi medici Formlabs che sto usando sono conformi al regolamento UE sui dispositivi medici (MDR) entrato in vigore il 26 maggio 2021?
Dispositivi di Classe I: le modifiche si applicano solo ai dispositivi prodotti dopo il 26 maggio 2021.
Secondo l’articolo 120, paragrafo 4 del regolamento MDR dell’UE, i dispositivi legalmente immessi sul mercato ai sensi della direttiva 93/42/CEE (MDD) anteriormente al 26 maggio 2021 possono continuare ad essere messi a disposizione sul mercato o a essere messi in servizio fino al 27 maggio 2025.
Pertanto, Formlabs certifica che i suoi dispositivi di Classe I prodotti prima del 25 maggio 2021 e con data di scadenza entro e non oltre il 25 maggio 2023, possono essere usati e venduti ai sensi del regolamento MDR dell’Unione Europea.
Scarica il comunicato ufficiale.
Dispositivi di Classe IIa: nessun cambiamento fino al 2024* (per le date esatte controlla il comunicato ufficiale)
Secondo l’articolo 120, paragrafo 4 del regolamento MDR dell’UE, i dispositivi legalmente immessi sul mercato ai sensi della direttiva 93/42/CEE (MDD) in virtù di un certificato valido (valido fino alla scadenza del termine indicato sul certificato) possono continuare ad essere immessi sul mercato o messi in servizio fino al 27 maggio 2025.
Pertanto, Formlabs certifica che i suoi dispositivi medici di Classe IIa possono essere usati e venduti secondo il regolamento MDR dell’Unione Europea.
*Scarica il comunicato ufficiale.
Per i dispositivi medici prodotti da Formlabs dopo il 26 maggio 2021, quali cambiamenti saranno visibili sulle etichette?
L’etichettatura comprende: le istruzioni per l’uso, l’etichetta sul retro e qualsiasi altra etichetta presente sulla cartuccia o sulla confezione. Un’etichettatura conforme al regolamento UE sui dispositivi medici (MDR) è diversa da un’etichettatura conforme alle direttive sui dispositivi medici (MDD), in quanto dovrebbe includere:
-
Il simbolo “MD” (Medical Device), che indica che il prodotto è un dispositivo medico
-
Nome dell’importatore
-
UDI (Unique Device Identification, Identificazione unica del dispositivo)
-
Istruzioni per l’uso insieme ai benefici clinici, i rischi residui e altri requisiti di cui all’allegato I
I prodotti Formlabs saranno accompagnati da etichette conformi al regolamento MDR (ove applicabile). Si precisa che il solo fatto che l’etichettatura includa tutti i punti sopra elencati non garantisce che il dispositivo medico in questione soddisfi la totalità dei requisiti stabiliti dal regolamento MDR.
Quali certificazioni sono necessarie?
I dispositivi di Classe I non richiedono una certificazione, solo una dichiarazione di conformità (DoC), che è costituita dall’autocertificazione del produttore. Questi dispositivi devono ancora essere prodotti ed etichettati in conformità al regolamento.
I dispositivi di Classe IIa richiedono un certificato CE rilasciato da un organismo notificato e una dichiarazione di conformità (DoC).
Cosa significano questi cambiamenti per Formlabs?
Questi cambiamenti hanno diverse implicazioni per i dispositivi Formlabs.
Dispositivi Formlabs di Classe I
-
I dispositivi di Classe I, una volta esaurite le scorte, passeranno da prodotti conformi alle direttive MDD a prodotti conformi ai sensi del regolamento MDR.
-
Formlabs sarà in possesso di una dichiarazione di conformità (DoC) ai sensi del regolamento MDR.
-
I prodotti avranno etichette e istruzioni per l’uso conformi al regolamento MDR.
Dispositivi Formlabs di Classe IIa
-
Quando la Dental LT Clear Resin (V2) sarà disponibile in Europa, sarà provvista di un certificato CE in conformità al regolamento MDR e il sistema di qualità Formlabs verrà certificato in conformità alla medesima normativa.
Dispositivi di terze parti di Classe IIa
-
I dispositivi di Classe IIa manterranno un certificato di conformità alla direttiva MDD e non verrà apportata alcuna modifica fino alla scadenza di tale certificato (a seconda del certificato, non oltre il 26 maggio 2024)
Quando sarà disponibile la dichiarazione di conformità (DoC) MDR per i prodotti Formlabs?
Tutti i dispositivi medici di Classe I distribuiti da Formlabs e prodotti dopo il 26 maggio 2021 hanno bisogno di una nuova DoC. I dispositivi Formlabs di Classe I prodotti dopo il 25 maggio 2021 saranno accompagnati da una dichiarazione di conformità (DoC) ai sensi del regolamento MDR.
La dichiarazione di conformità (DoC) MDR è applicabile sia per le resine che per le stampanti?
La dichiarazione di conformità (DoC) ai sensi del regolamento MDR si applica a tutte le resine di Classe I vendute da Formlabs. Tuttavia, non è applicabile alle stampanti Formlabs. La dichiarazione di conformità (DoC) delle stampanti varia a seconda delle legislazioni.
Quali sono i requisiti per i clienti Formlabs appartenenti al settore odontoiatrico?
Ai sensi del regolamento MDR, laboratori odontotecnici e studi dentistici vanno ora considerati produttori. Qualsiasi prodotto riconosciuto come dispositivo medico va realizzato secondo un sistema di qualità stabilito.
I produttori devono:
-
Soddisfare tutte le voci applicabili previste dai requisiti generali di sicurezza e prestazione
-
Rispettare tutti i requisiti di post-commercializzazione
-
Registrarsi come produttori di dispositivi medici (ciascuno per la propria regione)
-
Scrivere una dichiarazione dei requisiti di cui all’allegato XIII (simile a una DoC)
-
Nominare una persona responsabile della conformità normativa
Come può Formlabs aiutare i clienti a soddisfare i loro obblighi ai sensi del regolamento MDR?
Formlabs può aiutare i clienti a soddisfare i requisiti generali di sicurezza e prestazione (allegato I del regolamento MDR) fornendo su richiesta:
-
Certificato di analisi ⇒ mostra il controllo dei lotti e la qualità
-
Certificato di conformità ⇒ mostra la conformità all’allegato I
Altri documenti a sostegno della conformità:
-
Dichiarazione di conformità dei dispositivi medici; scarica i documenti nella sezione “Download" per ogni applicazione (se del caso)
-
Scheda tecnica; scarica i documenti nella sezione “Download" per ogni applicazione
-
Scheda dati di sicurezza; scarica i documenti in fondo alla pagina
-
Documentazione che dimostra la conformità dei dispositivi di Classe I ai sensi del regolamento MDR (prodotti prima del 26 maggio)
-
Documentazione che dimostra la conformità dei dispositivi di Classe IIa ai sensi del regolamento MDR
Il software Dashboard online di Formlabs, tenendo traccia di attrezzature e materiali, aiuta con gli obblighi di documentazione dell’articolo 5.
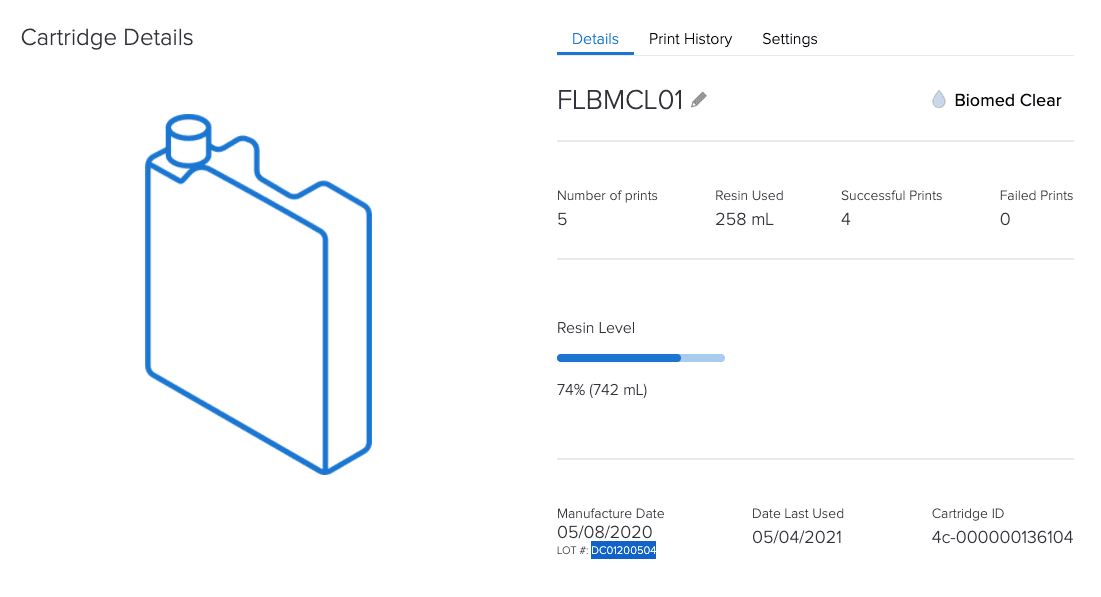
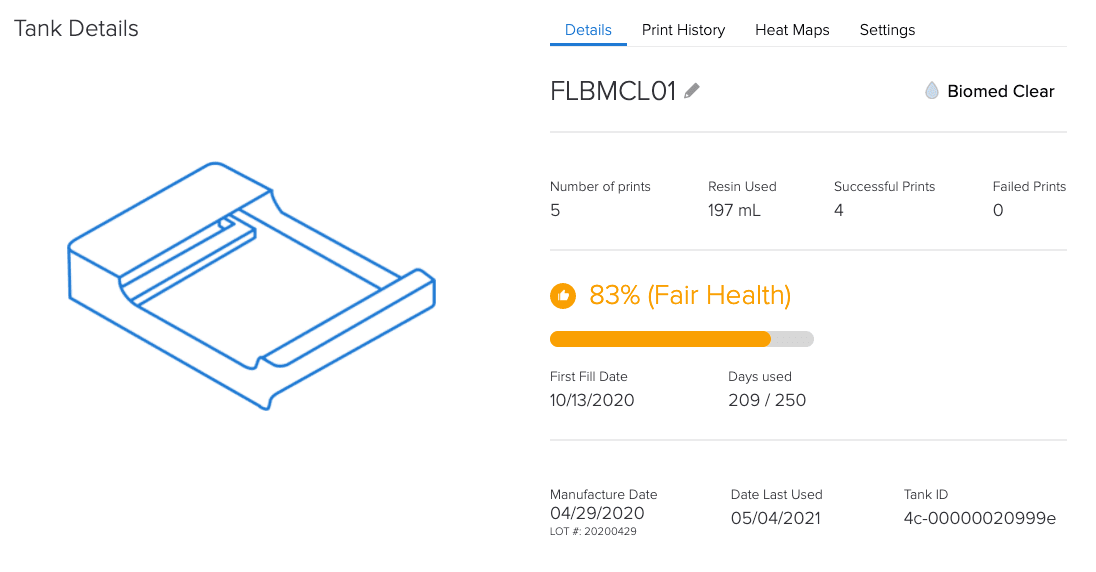
In che modo l’ecosistema controllato di Formlabs è un vantaggio ai sensi del regolamento MDR?
Dal momento che tutti i clienti del settore odontoiatrico (laboratori odontotecnici e studi dentistici) e le istituzioni mediche devono soddisfare tutti i requisiti del regolamento MDR, l’uso di un sistema controllato aiuta a garantire sicurezza e conformità.
-
Un sistema controllato garantisce la totale conformità all'allegato I, sia per la stampante che per i materiali.
-
Una valutazione clinica a sostegno dei materiali e della stampante.
-
Conformità sotto forma di documentazione specifica per ogni lotto e documentazione digitale.
Le stampanti e i materiali Formlabs, nonché i prodotti associati, sono conformi a una serie di norme di sicurezza e qualità in diverse giurisdizioni. Puoi trovare maggiori informazioni qui.
Scopri di più sul MDR
Guarda il nostro webinar sull'MDR in cui Sam Murray, direttore del dipartimento di Quality Assurance e Regulatory Affairs di Formlabs, fornirà una panoramica dettagliata di questo nuovo regolamento e che cosa comporta per i clienti Formlabs.